나노안전성이란?
나노안전성이란?
섬유 내 나노입자
섬유 산업(textile industry)은 의류, 가사용품, 퍼니싱(furnishing) 및 기술적 목적으로 전 세계적으로 섬유를 생산해내는 소비자 제품과 관련된 가장 중요한 산업 중 하나에 속한다. 다른 화학적 공정 및 기술과 마찬가지로 섬유의 상이한 기능을 추가하거나 이를 향상시키기 위해 나노물질이 사용된다. 이러한 나노물질은 인간 및 환경에 역효과를 미칠 수 있다. 나노물질의 적절한 선택과 직물 내 신중한 통합(integration)을 통해 이러한 역효과를 줄일 수 있다.
- 직물과 섬유
- 섬유는 뜨개질, 코바늘 뜨개질 또는 매듭 장식으로 형성되고 의류, 가사용 섬유(예컨대 침대 및 테이블 리넨(linen), 주방 및 세척용 천), 퍼니싱 섬유(예컨대 커튼, 업홀스터리 패브릭, 바닥 마감재) 그리고 기술적 섬유(예컨대 방호복, 카시트 커버, 타폴린(tarpaulins), 타이어 패브릭(tire fabric), 필터 재료, 토목섬유(geotextiles)[1]와 같은 다양한 분야에서 사용된다.
- 섬유는 직물(fibre)로 만들어지며, 이때 직물은 ‘그 지름의 최소 100배 이상의 길이, 명확한 우선성장방향(preferred orientation)을 가진 긴 사슬 분자 구조, 10 내지 200 미크론(microns)의 지름 그리고 유연성(flexibility)‘을 가진 길고 매우 얇은 물체로서 기술적으로 정의된다.[2, 3]
- 염색과 같은 화학적 변화(chemical alterations)는 직물의 특성을 변화시킬 수 있고 나노물질을 포함하는 신 기술 및 공정에 의해 기능을 향상시키거나 새로운 기능을 추가시킬 수 있다. 스마트 섬유(smart textiles)는 현재 규모가 큰 연구 주제로서, 이러한 스마트 섬유에는 다양한 용도로 전자장치 및 센서가 부착될 수 있다.
나노의학
나노물질은 다양한 질병 치료를 위한 새로운 주요 선택사항으로 간주된다. 의학용 나노물질은 이미 다양한 약물, 진단 및 임플란트를 위해 사용되고 있다. 현재 나노의학과 관련된 건강 분야에서 나노물질을 사용하기 위한 추가 가능성을 탐구하기 위해 집중적인 조사가 수행되고 있다. 어떤 물질이 지금 바로 이용될 수 있으며 어떠한 신규 작용물질(agents)이 미래에 이용될 수 있는가? 그리고 과장된 기대감에 의해 야기된 실망을 막기 위해서 어떻게 현명하게 대처할 수 있는가?
나노입자는 의학에서 오랜 역사를 가지고 있다. ‘나노기술‘이라는 용어가 생기기 훨씬 전에 콜로이드금(colloidal gold)(오늘날은 나노금(nanogold)라고 함)이 류마티스 관절염에 사용되었다.
- 1. 나노 크기의 은 입자가 오랜 기간 동안 특히 피부과에서 항세균제(antibacterial agents)(예컨대 화상 치료제)로서 사용되었다.
- 2. 나노기술의 개발과 함께, 나노기술은 또한 의료 목적으로 나노입자의 특정한 특성을 이용하기 위한 흥미로운 개념이 되었다.
이와 관련하여 아래의 두 가지 측면이 중요하다:
- 첫째, 약제는 나노 크기 범위의 입자를 포함해야만 한다.
- 둘째, 큰 입자나 용해된 형태의 화학 성분으로는 달성될 수 없는 특정한 특성들이 획득되어야만 한다.
2013년에 발표된 요약문에서는 임상적으로 승인된 시장에 나온 나노 약제로서 정확하게 100종의 제품을 들고 있으며, 이때 임플란트나 외과기계와 같은 의료 장비가 포함된다.
- 3. 임플란트의 경우 예컨대 티타니아(titiania)로 만들어진 나노 구조의 표면은 상처치유를 촉진하고 염증을 가라앉힐 수 있다.
- 4. 지금까지 43종의 제품이 나노 약제로서 승인 받았다(2014년에 산출됨, 예컨대 인플루엔자 백신, 항암제 및 항 진균증(fungal infections) 약제).
- 5. 승인된 나노 약제의 대부분은 종양 치료를 목표로 하고 있지만, 전체적으로 광범위한 적용 분야를 갖는다. 즉, 전염병, 통증 치료, 진단학적 용도, 백신, 자가면역질환 및 장기 이식을 위해 필요한 면역억제 등의 분야도 포함된다.
나노 의학의 주요 측면은 입자의 크기이다. 입자 크기는 조직 통합성(tissue integrity)이 방해될 경우에 조직, 특히 종양 내 침투를 향상시키는데 있어서 중요한 역할을 할 수 있다. 항암제가 이러한 방식으로 종양 내로 수송되면 그 위치에서 이용 가능한 용량이 매우 높아질 수 있다. 이러한 효과는 이미 다수의 나노 약제에서 활용되고 있다. 다른 입자들은 특정 세포에 의한 우선 흡수(preferential uptake)를 목표로 하고 있다. 이러한 효과는 백신의 경우에 중요한데, 이러한 백신은 면역계의 특정 세포에 의해 흡수되어 효과를 나타내야만 한다. 또한, 인체 장벽을 침투할 수 있는 몇몇 나노입자의 능력을 활용할 수 있는 가망성이 있다. 예컨대 폐 안에서 입자가 혈액 안으로 직접 이동될 수 있는데, 이는 약물 치료가 주입 대신에 흡입을 통해 이루어질 수 있음을 의미한다. 또 다른 흥미로운 목표는 혈액뇌장벽(blood-brain-barrier)이다. 이러한 혈액뇌장벽은 대부분의 병원체에 대한 노출로부터 뇌를 보호하지만, 유감스럽게도 그 기관에 약물이 도달하는 것도 막는다.
대개 많은 양의 나노입자가 인체 장벽을 침투하기는 어렵다. 이는 안전성 측면에서는 긍정적이지만, 의료에 적용되기 위해서는 연구원들이 이러한 과정을 강화하기 위해 큰 노력을 기울이고 있다. 알츠하이머와 같은 질병에 있어서는 약물이 뇌에 도달해야만 하며, 결국 나노의학이 그와 관련된 문제를 해결하는데 기여할 수 있을 것이다. 이러한 유형의 적용이 아직 기초 연구 단계에 있으며 임상실험을 거치지 않는 반면, 철을 포함한 나노입자는 이미 몇몇 유형의 뇌종양 치료에 사용되고 있다. 그러나 이러한 나노입자는 아주 가느다란 주사기로 수술을 통해 종양 안으로 운반되어야 한다. 마찬가지로 철을 기반으로 하지만, 전체적으로 완전히 다르게 적용되는 또 다른 약물이 장(gut)을 더 잘 보이게 하기 위해 사용되는데, 이는 다른 질병의 진단결과를 향상시키는데 도움이 된다. 이와 동시에 그러한 진단 입자가 약물을 포함하는 것 또한 흥미로운 개념이다. 이러한 개념은 ‘세라노스틱(theranostics)‘으로 이어지는데, 이때 입자는 진단과 치료를 위해 동시에 사용된다.
어떻게 인체가 나노입자를 제거하는가?
(예컨대 주입 후에) 인체 내에 존재하는 나노입자는 광범위하게 흡수되고 세망조직구계(RHS, reticulohistocytic system)에 의해 제거된다. 이러한 RHS는 인체의 기관을 통해 분포되는 세포 망을 나타낸다. RHS의 기능은 죽은 세포, 박테리아, 바이러스 및 침투된 미립자의 불활성화 및 제거이다. 나노입자 또한 이러한 ‘침투물질(infiltrates)‘에 속한다.
RHS, 즉 세망내피계(RES, reticuloendothelial system) 또는 단핵식세포계(MPS, mononuclear phagocyte system)는 인체 전반에 분포되는 세포 및 조직 망이며 특히 피, 간, 비장, 폐, 림프절 및 골수에 풍부하게 분포되며, 결합조직(connective tissue) 및 뇌에도 분포된다. RHS의 세포는 혈액과 조직 내에서 특정한 물질들을 흡수하고 분해시키며 효소의 도움으로 그 물질들을 비활성화시킨다. 따라서 이러한 세포 망은 질병에 대한 중요한 면역 방어 기능을 갖는다.
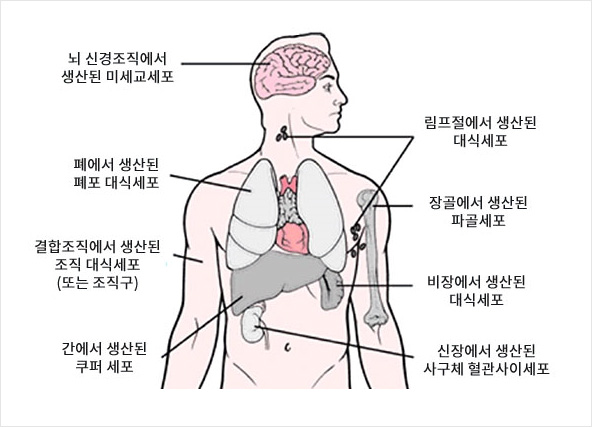
RHS에 대한 개요도(Frazier et al., 1996년)
RHS에 의해 흡수된 입자상 물질(particulate materials)은 죽은 세포, 박테리아, 바이러스 지방 입자 그리고 나노입자와 같은 고형 입자를 포함한다. 진단 또는 치료 목적(예컨대 암 치료)으로 정맥을 통해 혈액 안으로 주입되는 나노입자는 간의 쿠퍼 세포(Kupffer cell)에 의해 60% 내지 90%까지 흡수되고 비장에 의해 2% 내지 20%까지 흡수된다. 그 나머지는 RHS의 다른 세포 안으로 분포된다[1-4]. 따라서 인체 분포(body distribution)는 입자의 표면 특성에 의해 좌우된다. 이러한 이유로 혈액순환 시간이 연장될 수 있거나 그 인체 분포가 특정한 코팅 물질을 통해 변할 수 있다. 결과적으로 특정 종양 내 강화된 농도가 달성될 수 있다[5-7].
근육 내 또는 피하 주사는 로컬 림프절 내 입자의 우선 축적(preferential accumulation)을 초래한다[8, 9].
결론: 특정한 표면 변화 없이 나노입자의 90% 이상이 RES에 의해 인지되고 이러한 세포에 의해 흡수되며 그런 다음 인체로부터 폐기 및 제거된다. 따라서 치료 목적의 입자들은 특히 강화된 종양 농도(enhanced tumour concentration)를 달성하도록 만들어져야 한다.
태반장벽에 있는 나노입자
태반은 산모로부터 태아를 분리하는 중요한 세포장벽이다. 태아는 성장하는 동안 음식을 공급하는 태반의 적절한 기능에 전적으로 의존하며 이 기관의 유일한 생리학(unique physiology) 및 구조적 복잡성에 의해 보호받는다. 영양분과 산소가 태아에게 침투되어야 하기 때문에 폐기물과 이산화탄소가 다른 방향으로 수송되어야 한다. 나노입자는 태반장벽을 통과하여 태아에게 영향을 미칠 수 있다.
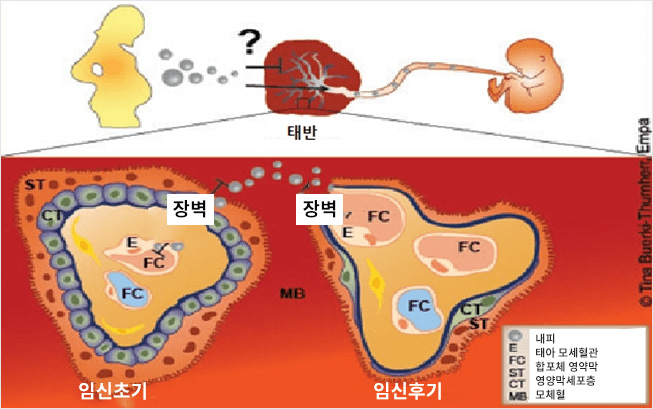
임신 초기및 임신후기의 태반장벽에 관한 개요 (Tina Buerki-Thurnherr, Empa)
태반장벽은 주로 두 개의 상이한 세포층으로 형성되는데, 그 중 하나는 산모 측으로부터 그리고 다른 하나는 태아 혈관으로부터 형성된 것이다. 임신 초기에는 이러한 장벽이 성장하는 태아를 보호하기 위해서 매우 두껍게 형성된다. 임신이 진행되면서 태반장벽은 가스 및 영양분 교환을 향상하기 위해 더 얇아진다. 태반은 수송에서부터 임신 중 내분비 및 면역 지원에 이르는 매우 다양한 기능을 갖는다. 많은 물질에 있어서 태반이 천연 장벽이라는 사실에도 불구하고, 1950년대와 1960년대에 탈리도마이드(thalidomide)에 의해 유발된 선천성 결함의 발견 이후로 태반이 뚫기 어려운 장벽이라는 믿음이 무너졌다. 오늘날은 몇 가지 환경 오염물질, 알코올, 치료 약제 및 불법 약제가 태반을 통과할 수 있는 것으로 인식된다. 따라서 가공된 나노물질의 사용 증가는 나노입자의 모체에서 태아로 이르는 수송 가능성 및 배아(embryo)에 미치는 부작용에 대한 우려를 일으킨다.
최근 몇 년간 나노입자가 태반장벽을 통과하고 태반 조직 및/또는 성장하는 태아에 급성독성(acute toxicity)을 유발할 수 있는지를 파악하기 위한 몇 가지 연구들이 실행되었다. 그러나 이러한 연구들은 드물게 이루어지므로 나노입자의 태반 수송 및 효과에 대한 지식은 여전히 매우 제한적이다. 이러한 연구는 윤리적인 문제로 인해 임산부에게 직접 수행될 수 없다. 그에 대한 대안책으로는 임신 중인 동물(대개 생쥐)에 대한 실험, 생체 외(in vitro) 세포 배양 그리고 인체 태반을 이용한 생체 밖(ex vivo) 모델이 있다.
- 생쥐 연구
- 임신한 쥐가 상이한 나노입자(예컨대 이산화티타늄, 이산화규소, 탄소나노튜브)에 노출되면 임신 합병증이나 태아에게 치명적인 영향을 미치지만 기타 다른 나노입자(예컨대 금(gold) 나노입자)에 노출된 경우는 그렇지 않다. 흥미로운 사실은 태아에 미치는 부작용이 단지 나노입자 자체에 의해서만 유발될 수는 없다는 것이다. 이러한 연구가 임신한 생물체 내 상이한 나노입자의 분포 및 작용에 대한 최초의 정보를 제공할지라도, 태반은 상이한 종 내에서 매우 독특한 해부학적 및 생리학적 특성을 지니기 때문에 이러한 결과를 인간에게 적용하는 것은 문제가 될 수 있다.
- 태반 관류 모델
- 현재 제왕 절개 수술 직후에 획득된 인체 태반의 관류는 태반 경유 수송(transplacental transfer) 연구를 위한 ‘금본위제도(gold standard)’를 나타낸다. 이러한 방법을 이용한 첫 번째 결과는 입자 수송이 크기, 재료 구성 및 표면 변형에 따라 좌우됨을 보여주었다. 또한, 산모에서 태아로의 나노입자 수송보다는 태아에서 산모로의 수송이 더 많음을 확인할 수 있는데, 전자의 경우는 능동적이고 에너지 의존적인(energy-dependent) 수송 메커니즘을 보여준다. 이와 같은 생체 밖 모델(ex vivo model)의 가장 큰 이점은 낮은 처리율(throughout) 및 짧은 관류 시간이다.
- 생체외(in vitro) 모델
- 생체 밖(ex vivo) 관류 체계와 달리 생체외(in vitro) 세포배양 연구는 상이하게 변형된 다수의 나노입자를 시험하기 위한 높은 처리율에 대한 요구를 충족시킨다. 이러한 연구들은 생체내(in vivo) 상황에서는 예측하기가 쉽지 않지만, 나노입자의 최초 평가를 가능하게 한다. 많은 다른 세포 유형 중에서 BeWo 세포는 가장 빈번하게 사용되는 세포 유형이다. 이러한 BeWo 세포는 인체 종양 조직에서 비롯되며 모델 내에서는 모체 측을 나타낸다. 수송 연구와 관련하여 BeWo 세포는 두 가지 챔버 장치 내에서 다공성 막(porous membrane) 상에서 배양되며, 이때 물질은 상부 챔버에 부가될 수 있고 수송은 시간이 지나면서 더 낮은 구획(compartment)에서 모니터링될 수 있다. BeWo 트랜스웰(transwell) 모델을 이용한 연구는 결과적으로 예컨대 폴리스티렌(polystyrene), 실리카(silica) 및 산화철(iron oxide) 입자의 수송을 보여준다.
그러나 단지 나노 안전성 문제만을 과학자들이 다루는 것은 아니다. 나노물질이 신규 나노의학 치료 개발을 위해 사용될 수 있다는 높은 기대치가 있다. 임신 중에 의학적 치료에 의존하는 임산부의 수는 매우 높으며 위험성이 공지된 약물의 사용이 보고된다. 나노의학은 특히 임산부, 태아 질병 또는 태반 합병증을 감소된 또는 강화된 태반 수송을 가진 나노입자의 식별에 의해 또는 태반 조직 내 축적에 의해 치료하기 위한 새로운 치료 접근법을 제공할 수 있다. 따라서 흡수 메커니즘과 인체 태반 상에서의 나노입자 이동을 이해하는 것도 매우 중요하지만, 그러한 과정들은 나노입자의 물리화학적 특성 또는 표면 기능화(surface functionalization)를 통제함으로써 조절될 수 있다.
페인트 내 나노입자
일반적으로 ‘페인트(paint)’라는 용어는 고체 표면을 보호, 밀봉 또는 염색하기 위해 코팅하는데 사용되는 액체를 가리킨다. 이러한 목적으로 고체 미립자와 같은 안료들은 중요한 역할을 수행하며 밀레니엄 이후로 예컨대 동굴 벽화 등에 사용되어 왔다. 오늘날 나노물질은 페인트의 효율성을 향상시키고 새로운 기능을 부여하기 위해 사용되고 있다. 이미 몇몇 나노 강화(nano-enhanced) 페인트가 시장에 나와 있다. 최근 연구에서는 나노물질을 포함하는 페인트의 이점과 위해성이 조사되었다. 개혁의 초기 단계 동안 이점 및 위해성을 연구하는 작업은 나노 페인트의 위해성을 방지하고 그 사용 기회를 최대화하는데 도움이 될 것이다.
페인트는 물질들(안료, 수지/결합제, 용제 및 첨가제)의 복합 혼합물이다. 이러한 물질들은 대개 벽(실내), 파사드(facades)(실외), 차량 및 가구에서 서로 다른 용도로 사용된다. 표면 유형, 예컨대 콘크리트, 벽돌, 돌, 목재, 금속 또는 유리에 따라서 특정 요건에 맞게 개발된다: 외관 장식; 방사선, 습기/수분, 미생물에 대한 보호; 소방 및 단열. 물- 및 기름 기반 페인트가 있으며, 이러한 페인트는 소비자 요구에 따른 추가 기능들을 갖는다. 나노물질은 예컨대 방수/먼지 퇴치, 세척 용이성, 자외선 차단, 항생제 내성, 스크래치 저항성(scratch resistance) 또는 페인트 수명 연장과 같은 기능들을 향상시키는 것으로 추정된다.
페인트 내 나노물질의 기능적 이점
| 기능 | 나노물질 유형 | |||
|---|---|---|---|---|
| 이산화티타늄 | 이산화규소 | 은 | ||
| 아나타제 (anatase) | 루타일 (rutile) | |||
| 안티그라피티(anti-graffiti) | X | |||
| 살균 작용 | X | X | ||
| 세척 용이성 | X | X | ||
| 난연성 | X | X | ||
| 자가 세척 | X | |||
| 스크래치 저항성 | X | |||
| 단열 | X | X | X | |
| 자외선 차단 | X | |||
| 방수 | X | |||
현재 페인트 산업에 사용되는 대부분의 나노물질들은 나노 규모의 이산화티타늄 및 이산화규소이며, 은, 산화아연, 산화알루미늄, 이산화세륨, 산화구리 및 산화마그네슘도 연구 중에 있다. 위에 제시한 표는 페인트 내에 나노물질을 결합시킴으로써 나타날 수 있는 기능적 이점을 개괄적으로 보여준다.
페인트 유형과 바람직한 기능들에 따라 나노물질은 프리 파우더(free powders), 현탁액(suspension)/분산액(dispersion) 내 안정 입자(stablised particles)로서 통합될 수 있거나 마스터 배치(master batch) 또는 과립 내에 포함되어 페인트 매트릭스 내에 확실히 삽입될 수 있다.
또한, 나노 구조 표면을 가지고 나노다공성(nanoporous) 물질을 포함하거나 일시적으로 나노 구조 입자(예컨대 페인트가 마르는 동안 물유리(water glass)로부터 생산됨)를 포함하는 페인트 또는 제품들이 존재한다. 이러한 최종 제품들은 나노물질을 포함하지 않기 때문에 인간 또는 환경에 어떠한 나노 관련 위해성도 가하지 않는 것으로 간주된다.
- 페인트 내 나노물질의 효과
- 나노 이산화티타늄은 그 우수한 특성을 이용하기 위해 페인트 내에 사용된다: [1] 광촉매 작용 및 [ii] 자외선 차단.
광촉매 효과(photo-catalytic effect)와 친수성(hydrophilic property)의 결합은 페인트의 자가 세척 효과를 야기한다. 표면은 더 이상 물에 의한 일반 세척이 필요하지 않고 더 이상 표면 위에 먼지가 붙지 않는다. 그러나 연구 결과에 따르면 유기성 페인트(organic paint) 내 광촉매 나노 이산화티타늄이 자외선 조사(UV irradiation)에 의해 결합제의 품질을 저하시킨다고 한다. 이러한 이유로 유기성 파사드 코팅(organic façade coating)에서는 자외선 차단을 위해 루타일형(rutile type)이 선호된다.
페인트에 나노 이산화규소를 첨가하면 마크로(macro)- 및 미크로(micro) 경도(hardness), 마모, 스크래치 및 내후성(weather resistance)이 향상될 수 있다. 고분자수지에 나노 이산화규소를 첨가하면 탁월한 마모특성(abrasion property)을 지닌 페인트가 만들어진다. 그러나 이는 페인트의 탄성(elasticity)을 낮추게 된다. 페인트의 탄성은 온도 및 습도 변화에 따른 팽윤(swelling) 및 축소에 저항하기 위해 필요하다.
나노은(nano silver)을 포함하는 페인트로 코팅된 표면은 박테리아와 인체 병원체(pathogen)에 대한 탁월한 항균 특성을 제공한다[7]. 그러나 실내 페인트와 달리 실외에서 사용되는 페인트 내 나노은의 살균효과는 외부 조건에 대한 노출로 인해 불충분한 것 같다. 연구에 따르면 나노은 및 나노 이산화티타늄은 균질 콜로니제이션(fungal colonization)에 대한 불충분한 억제력(deterrent)을 지닐 뿐만 아니라 시험 물질 상의 미생물 및 조류(algal) 성장을 충분히 막을 수 없다.
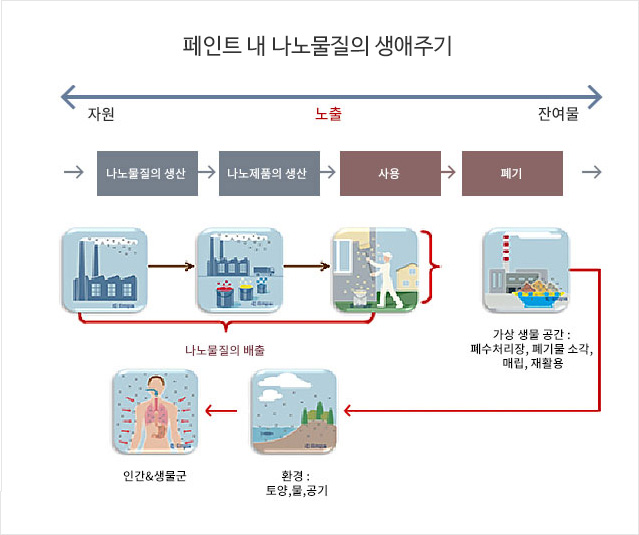
나노하우스(NanoHouse)와 같은 최근 프로젝트는 페인트, 주로 파사드(실외) 페인트 내 나노물질의 통합에 대한 이점 및 위험성을 조사하였다. 이러한 조사의 주요 초점은 페인트로부터 나온 나노물질의 환경 내 배출이 페인트의 생애 주기(예컨대, 생산, 사용 및 생애 말기) 동안 가능할 수 있는지를 확인하는데 맞춰져 있었다. 마모, 풍화 및 침출(leaching)이 진행된 후에는 분석된 나노물질 중 어떠한 물질도 공기 중에 크게 배출되지 않았으며 단지 소량의 이산화티타늄과 이산화규소 만이 물 안으로 배출되었다. 페인트 잔해의 소각 후에 발생한 재(ash)에서는 이러한 세 가지 나노물질(TiO2, SiO2, 은) 만이 관찰되었다. 나노물질을 포함하는 페인트에 대한 분석 결과에 따르면 단기적으로는 종래의 파사드 페인트와 유사한 독성을 나타냈지만, 장기간 실험의 수행이 권장되었다.
나노하우스 또한 페인트 내 나노물질의 사용이 환경에 유익한지 아닌지를 평가하기 위해 전과정 평가(LCA, life cycle assessment)를 수행하였다. 나노 페인트를 사용할 경우 환경편익의 향상은 대개 실제 구성성분 및 기능성에 따라 좌우되므로 일반화될 수 없다. 또한, 나노물질 및 나노 페인트의 생산은 환경에 큰 영향을 미친다. 나노물질을 페인트 제제 내에 통합하는 것이 하나의 편익을 제공할 수 있으며, 이로 인해 나노 페인트의 생산이 종래 페인트에 비해 더 큰 영향을 미치는 것에 대한 과잉 보상(over-compensate)이 이루어질 수 있다.
나노하우스 프로젝트는 나노물질의 의도되지 않은 배출 및 노출과 관련된 다음과 같은 핵심 요소들을 확인하였다:
- 나노물질의 생산, 건설재료의 리노베이션 또는 재활용 동안의 배출
- 나노물질의 생산, 페인트 내 나노물질의 통합 및 페인트 사용으로부터 발생한 ‘나노 폐기물’
- 산업 폐기물 및 매립지 내 소각으로부터 나온 잔류물의 처리
나노 페인트와 관련하여 그 생산, 유지 및 재활용 시 먼지 발생을 피하기 위해 노동 위생 측면에 특별한 주의를 기울이는 것이 권장된다. 또한, 위험성(배출 및 효과)을 방지하고 기회를 최대화하기 위해서 나노물질 및 페인트 제제를 선택하고/변형하는 safe-by-design 방식을 이용하여 개혁 초기 단계 동안에 제시될 수 있는 이점들을 조사하는 것이 중요하다.
나노입자 및 피부
피부는 인체의 가장 큰 기관이며 유기체에 의해 발생한 질병, 독성 화학물질 및 기계적 손상에 대해 인체를 보호한다. 나노입자는 온전한 피부를 쉽게 침투할 수 없을 뿐 아니라 피부 내 표재성 손상(superficial injuries)을 통과할 수 없다. 피부에 가해진 낮은 레벨의 기계적 응력(mechanical stress)은 각질층(stratum corneum)에 의해 완화된다. 이코르(ichor) 분비물 및 다른 혈액 성분들은 깊은 찰과상을 입은 피부를 해로운 영향으로부터 보호한다. 그러나 나노입자는 모공 안에 침전되고 이와 같은 흡수 경로가 의학에서 나노입자 결합 약물 또는 백신의 배출을 위해 사용된다. 이러한 나노입자는 결국 인체에 전달된다. 일반적으로 피부에 붙은 나노입자는 씻어서 제거될 수 있다.
피부(cutis)는 세 가지 기본 층, 즉 표피(epidermis), 진피(dermis) 및 하피(hypodermis)로 구성된다. 모공은 모발 자체와 함께 표피 및 진피 내에 박힌다. 표피의 가장 위에 있는 층을 각질층이라고 하며, 이러한 각질층은 신체 부위에 따라 12개 내지 200개의 세포층으로 되어 있다. 세포 사이에 축적된 지질(lipid)과 함께 이러한 (죽은) 세포는 입자에 대한 보호 기능을 하는 발수성(water-repellent) 층을 형성한다. 이러한 기계적 장벽(mechanical barrier)은 미생물 또는 환경적으로 유도된 다른 물질들이 인체 안으로 유입되는 것을 제한하며 수분손실을 막는다. 피부는 매우 동적인 조직이며 끊임없이 재생된다.
친유성(lipophilic) 저분자 물질(예컨대 니코틴, 펜타닐(fentanyl), 부프레노르핀(buprenorphine), 성호르몬, 클로니딘(clonidine) 또는 니트로글리세린(nitro-glycerine))은 예컨대 약물 패치를 통해 비교적 쉽게 피부로 흡수될 수 있다. 이는 이론적으로 볼 때 나노입자의 유입 경로가 된다. 그러나 많은 연구에서 실행된 구체적인 분석 결과를 보면 조사된 나노입자의 어떤 것도 각막의 최상부 층을 통해서는 온전한 피부에 침투될 수 없다.
유럽 조사 프로젝트인 NANODERM은 일반적으로 자외선 차단제에서 발견되는 금속 산화물인 이산화티타늄 및 산화아연의 나노폼(nanoform)이 피부층을 침투할 수 있는 가능성을 광범위하게 조사하였다. 동 프로젝트에 따르면 이러한 입자가 매우 작음에도 불구하고 어떠한 입자나 집합체도 피부의 깊숙한 층 안으로 침투되지 않는 것으로 밝혀졌다. 2013년 7월 이후로 나노 금속산화물 성분을 포함하는 화장품들은 의무적으로 나노 라벨(예컨대 “이산화티타늄(나노)”)을 가지고 있다.
나노입자가 모공 내 피부 속으로 축적될 수 있다. 하지만 이때 피부에 순수하게 침투되는 것은 고려되지 않는다. 이러한 입자는 통상적으로 세척이나 피지(지방성 분비물)에 의해 그리고 모발 성장에 의해 제거될 수 있다. 약물과 같은 유효 성분(active ingredients)이 나노입자에 결합하면 이 성분들은 우선 모공 안으로 배출될 것이며, 그런 후에 피부를 통해 혈류에 수송될 수 있다. 이러한 운반체 및 배출 메커니즘이 이후의 약물 운송 그리고 주사바늘을 이용하지 않은 백신 접종을 용이하게 할 수 있다.
손상된 피부(예컨대 일광 화상)
각질층의 단단한 성질은 피부에 가해지는 작은 기계적 응력을 쉽게 처리할 수 있게 해준다. 창상(wounding)과 같이 깊게 패인 경우에는 이코르 분비물과 다른 혈액 성분들이 다른 유해한 영향으로부터 신체를 보호하기 위해 사용된다. 이산화티타늄 및 산화아연과 같은 나노입자들은 일광 화상을 입은 피부(자외선B에 의해 유발된 손상)에 침투되지 않는 것으로 밝혀졌고 따라서 표피 상부 층에 제한되어 있다.
피부는 미생물에 의해 유발된 질병으로부터 자외선 조사에 따른 손상 및 유독성 화학물질에 이르는 매우 광범위한 외부 스트레스 인자로부터 인체를 보호하는 매우 뛰어난 기관이다. 이러한 구조 및 특성에 의해 피부는 또한 가공된 나노물질의 침투에 대한 매우 효과적인 장벽이 된다.
완전 재생 – 4주마다
대부분의 체세포가 성장이 끝난 후에 분열을 멈추는 반면, 피부 세포는 생존 기간 내내 분열 능력을 보유한다. 놀라운 사실은 인간의 피부가 평균 28일 마다 완전히 재생된다는 것이다. 이러한 과정에서 표피의 최저 층에 있는 기저 세포(basal cells)는 반복해서 형성되고 상부에 가로놓인 층은 건조화(desiccation)와 각질화(hornification)가 진행되는 동안 위로 밀려져서 각질층을 형성하며, 이때 수분이 풍부했던 기저 세포가 각막의 건조하고 죽은 세포로 변형된다. 피부는 매일 죽은 각질 세포(horn cells)의 14그램까지 벗겨진다. 그러나 나이가 들면서 세포 재생 과정이 느려지며 피부는 수분 함량과 탄성을 잃고 외부 보호층으로서의 효과가 떨어지게 된다.
요약하면 자외선으로부터 피부를 보호하기 위한 자외선 차단제에서 사용된 이산화티타늄 및 산화아연과 같은 나노입자들은 건강한 동물의 피부 장벽을 침투할 수 없는 것으로 확인되었으며, 이는 다른 미립자의 경우에도 마찬가지로 적용된다.
나노입자와 면역체계
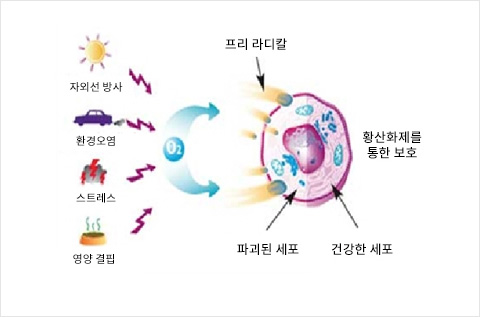
면역체계는 자기 엔티티(self-entities)와 비자기 엔티티(non-self-entities)를 동시에 식별한다. 나노입자와 같은 비자기 작용물질이 식별되면 면역 세포는 이러한 물질이 위험을 구성하는지 아닌지를 결정한다. 신체가 비자기를 식별하고 그것을 위험한 것으로 간주하면 면역체계가 염증으로 반응을 보인다. 질병을 유발하는 병원체의 경우에는 장소가 국한되어 박멸되며 부상이 발생하면 상처치유가 유도된다. 기술적으로 생산된 몇몇 나노물질은 염증을 촉진시키는 것으로 의심된다. 그러나 면역 반응에 영향을 미치는 능력은 의학적으로 유용할 수 있다.
따라서 나노물질의 안전성에 대한 조사는 신규 의학 치료의 개발에 기여할 수도 있다.
인간은 서로 밀접하게 협력하는 두 개의 방어 시스템, 즉 선천성(innative) 면역체계와 적응성(adaptive) 면역체계를 갖는다.
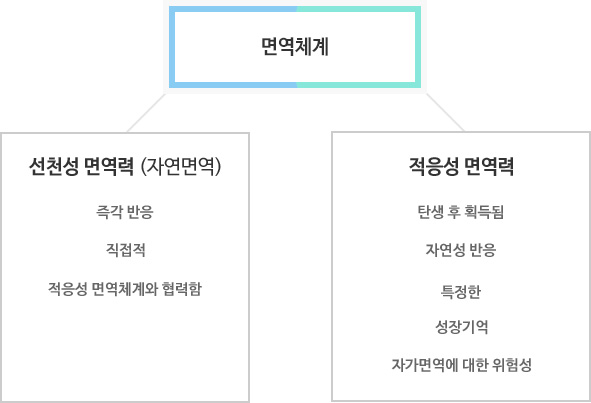
선천성 면역체계 및 적응성 면역체계에 대한 개요
선천성 면역체계는 유전적으로 프로그래밍되어 있고 모든 인간에서 동일한 형태를 갖는다. 이는 두 개의 상이한 자극제(stimuli)를 식별하는 광범위한 특정 결합 구조에 의해 자극된다. 이러한 자극제의 첫 번째 타입은 박테리아, 바이러스, 균류 또는 기생충 내에만 존재하는 성분들을 포함함으로써, 다른 유기체가 인체 내에 침입했는지를 보여준다. 한 예가 지질다당류(LPS, Lipopolysaccharide)이며, 이러한 지질다당류는 단지 박테리아에 의해서만 생산되는 박테리아 세포막으로부터 나온 분자로서 박테리아가 존재하는지를 식별할 수 있게 해 준다. 이러한 자극제가 자동으로 염증에 반응하는 것은 신체에 위험하게 작용할 것이다: 우리의 신체 표면은 끊임없이 박테리아와 접촉하며, 이는 거의 무해하다. 소화관 내에 인간은 소화에 긴급히 필요한 많은 양의 박테리아를 가지고 있다. 면역 반응은 다른 특정 구조가 위험을 알리는 신호를 식별하도록 자극된 경우에만 발생한다. 위험 신호는 세포 내에서 발생하는 물질이며, 이러한 물질은 괴사(necrosis)가 일어날 때 배출된다.
면역체계 스트레스 인자(©www.tierfachmarkt.de)
나노물질은 입자가 결합되어 있을 수 있기 때문에 때때로 선천성 면역력을 위한 자극제를 식별하는 결합 구조를 바로 활성화시킬 수 있다. 세포에 의해 식별되는 다른 위험 요소는 금속 또는 금속 산화물 입자로부터 배출된 독성 금속 이온이다. 또한, 활성산소(ROS, Reactive Oxygen Species)는 화학적으로 능동적인 몇몇 입자들의 표면 상에서, 예컨대 만성 염증이 일어나는 동안은 면역 세포에 의해서 생산될 수 있으며, 면역체계에 위험 경보를 알리고 면역체계를 활성화시키는 자극을 제공한다. 이와 관련된 연구는 LPS와 같은 박테리아 분자가 거의 모든 지점에서 발생하고 종종 나노물질의 오염물질로서 발견되는 문제를 다루어야만 한다. 나노입자의 염증 전(pro-inflammatory) 특성에 대한 이전 보고서들은 그러한 오염물질이나 비정상적으로 많은 양의 나노입자에 기인한 것일 수 있다.
그러나 몇몇 유형의 나노입자들은 염증을 촉진시킬 수 있다는 것이 명백하다. 이는 항생제나 암 치료에서는 유용할 수 있으나 일반 소비자 제품에서 사용될 경우에는 그러한 특성들이 문제가 될 수 있다.
염증을 일으키게 하는 선천성 프로그램 이외에도 인간은 적응성 면역체계를 가지는데, 이는 거의 무한정한 상이한 자극제를 식별하는 것에 적응하기 때문에 적응성 면역체계라 한다. 이러한 적응성 면역체계로부터 나온 세포는 침입하는 세포로부터 어떤 구조가 형성되는지를 ‘학습하고(learn)’ 생애 주기 동안 그것을 기억한다 – 이것이 백신 접종이 효과적인 이유이다. 나노입자가 이 시스템에 의해 곧 바로 식별될 가능성은 없다. 그러나 단백질이 입자에 결합되는 것은 문제가 될 수 있다. 입자가 인체 내에 들어가자 마자 단백질이 입자 표면에 들러붙게 됨으로써, 사실상 인간은 나노입자/단백질 복합체에 노출된다. 단백질 구조가 입자에 결합하면서 변경될 수 있으므로, 자가(self) 단백질이 비자가(non-self) 단백질로 간주될 수도 있다. 이로 인해 적응성 면역체계로부터 방어 메커니즘이 자극될 수 있다. 이러한 현상이 실제로 발생하는지는 명확하지 않지만, 이와 관련하여 집중적인 조사가 이루어지고 있다. 적응성 면역력에 대한 효과는 나노물질의 안전성을 평가하는데 있어서 고려되어야 한다. 나노물질이 면역체계를 활성화하거나 조절하는 능력은 의학적으로 이용될 수 있다. 나노물질(예컨대 금)과의 올바른 결합에 의해 예컨대 특히 효과적인 백신 생산이 가능할 수 있다.
토너
토너(toner)는 복사기 및 레이저 프린터에 주로 사용되는 매우 미세한 파우더이며 종종 지름 2 내지 30 미크론의 입자들로 구성된다. 작은 입자 크기로 인해 파우더는 액체와 같이 작용할 수 있다. 소비자는 예컨대 토너 카트리지가 교체되거나 용지 걸림이 제거되어야 할 때 장치가 정지된 상태에서의 보수 작업 동안 토너 카트리지나 종이가루에 접촉할 수 있다. 폐쇄된 하우징에 의한 인쇄 작동 동안, 휘발성 물질 및 나노입자들이 장치의 환기장치를 통해 주위 공기로 배출되어 흡입성 노출을 유발할 수 있다.
토너 – 재료

토너 입자 구조에 대한 개요(IUTA, 2014) 구조에 대한 개요(IUTA, 2014)
하나의 성분으로 된 토너는 기저 재료로서 중합체 수지, 안료(대개 카본 블랙) 및 자기성 금속 산화물(예컨대 산화철)을 사용하는 토너 입자로 구성된다. 안료는 기저 재료 안으로 통합되거나/및 토너 입자 표면 상에 코팅을 형성할 수 있다. 이산화규소 입자와 같은 첨가제가 색소 응괴(clumping)를 방지하는데 사용되고 망간, 크롬 또는 아연과 같은 재료들은 색소 안료의 기능을 갖는다.
인쇄 과정
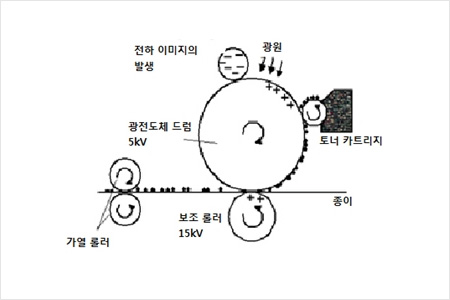
인쇄 과정의 원리(IUTA, 2014)
인쇄되는 동안 토너는 상이한 배출 가능성을 가진 다양한 과정들을 거치게 된다. 인쇄 과정의 원리가 위 도면에서 개략적으로 도시된다. 우선 인쇄 템플릿(template)이 광전도체 드럼 상에서 정전하(electrostatic charge)에 의해 투사된다. 토너가 카트리지 안에 제공되고 하전된(charged) 광전도체 드럼(photoconductor drum)에 부가되며, 이 광전도체 드럼 상에 토너 입자가 정전기적 인력(electrostatic attraction)에 의해 부착된다. 토너 입자를 종이에 수송하기 위해서 더 높게 하전된 보조 롤러가 사용된다. 종이는 광전도체 드럼과 보조 롤러 사이를 통과하여, 정전기력에 의해 토너 입자가 종이 위로 수송된다. 종이 위에서 토너 입자가 정착기(fuser unit) 내에서 가열 롤러(130 – 210℃)에 의해 고정된다.
- 배출
- 토너 입자와 관련하여 인체 건강에 상이한 영향을 미치는 경우와 다른 배출 시나리오가 존재한다. 토너 입자(2-30 마이크로미터) 또는 피부 자극성을 지닌 종이가루와의 피부 접촉은 예컨대 토너 카트리지가 대체되거나 용지 걸림이 제거되어야 할 때 장치의 정지상태에서의 보수 작업 동안 일어날 수 있다. 이러한 접촉은 장갑을 착용함으로써 방지될 수 있다.
- 폐쇄된 하우징에 의한 인쇄 작동 시 휘발성 가스 성분(예컨대 자일렌(XYLENE)) 및 나노입자가 환기 시스템(VENTILATION SYSTEM)을 통해 주위 공기로 배출될 수 있다. 나노입자는 그 크기 때문에 흡입될 때 더 낮은 호흡기에 도달할 수 있다. 작동을 통한 배출은 주로 가열 롤러에 의해 토너 입자가 종이에 부착됨으로써 야기된다. 휘발성 물질은 프린터의 플라스틱 부분, 종이 그리고 부분적으로 더 시원한 지점에 응축되어 새로운 나노 크기의 입자를 형성하는 토너 입자로부터 증발할 수 있다. 레이저 인쇄 시스템으로부터 나온 에어로졸의 분석은 규소, 유황, 염소, 칼슘, 티타늄, 크롬, 철, 브롬 및 극 미량의 니켈을 구성성분으로서 결정하였다. 철과 규소는 주 성분으로서 토너에, 칼슘과 염소는 종이에 그리고 브롬은 플라스틱 하우징 부분의 난연제에 부가된다.
- 일반적으로 프린터 및 복사기로부터 비롯된 배출을 조사하는 두 가지 유형의 연구가 구별될 수 있는데, 그 중 하나는 일반 사무 활동 동안 실제 사무실 내에서 수행되고 또 하나는 정해진 치수를 가진 시험 챔버(TEST CHAMBER) 내에서의 개별 레이저 프린터에 대한 시험에 따른 연구이다. 이러한 연구는 레이저 프린터 또는 복사기의 작동 동안 입자 및 가스 오염물질이 공기 중에 배출될 수 있음을 보여준다. 연구 결과는 레이저 프린터로부터 나온 입자수 농도가 다수의 인자, 예컨대 장치 유형 및 장치 연령, 토너 카트리지의 연령, 프린터의 작동 상태 및 그 설치 위치에 의해 영향을 받을 수 있음을 보여준다.
- 건강 측면
- 생체외(IN VITRO) 연구는 많은 양의 토너 먼지가 세포에 손상을 입힐 수 있다고 보여주었다. 많은 양의 토너 먼지에 노출되었던 생쥐에 대한 실험에서 입자들은 폐에 염증을 유발했다. 그러나 이때 투여된 양이 너무 많기 때문에 이 실험이 실제를 반영하는 것으로 보기는 어렵다.
- 개별 연구에 따르면 인체가 토너 먼지에 과민하게 반응할 수 있다고 한다. 지원자들을 한 복사 가게에서 하루 동안 머물게 한 후 그들의 상기도(UPPER AIRWAY)의 염증표지(INFLAMMATORY MARKER)를 측정한 연구에 따르면 유발된 염증이 늦어도 하루 뒤에는 사라짐을 확인할 수 있었다.
기본적으로 적용되는 사실은 다음과 같다:
- 복사기 및 프린터는 예컨대 오존, 자외선, 소음, 종이가루, 집 먼지 및 토너 먼지, 휘발성 유기 화합물 및 열과 같은 상이한 유형의 가스 및 입자성 물질의 배출을 유발할 수 있다. 배출의 범위는 장치의 유형 및 사용 환경(사용 빈도, 대기 조건 등)에 따라 좌우된다. 따라서 인쇄 장치의 특정 건강 유해성이 개별적으로 평가되어야 한다.
독일 연방직업안정연구소(BAuA) 및 스위스 재해보험공단(Suva)은 토너 먼지의 안전한 취급에 대한 권장사항을 발표하였다:
⟩ http://www.baua.de/en/Topics-from-A-to-Z/Hazardous-Substances/Toner_content.html
⟩ http://www.suva.ch/startseite-suva/suche.htm?q=Toner&site=suva
혈액뇌장벽에 있는 나노입자
혈액뇌장벽은 뇌로부터 혈관계를 분리하고 뇌 모세혈관을 둘러싸는 내피세포(endothelial cell)에 의해 형성된다. 일반적인 상황에서는 이러한 혈액뇌장벽은 나노입자에 대해 불투과성을 지닌다.
혈관계로부터 뇌를 분리하는 세포 장벽은 내피세포에 의해 형성된다. 인간의 모세혈관은 이러한 세포들(내피세포)에 의해 둘러싸여 있으며, 이러한 세포들은 세포들 간의 모든 물질 수송을 막는 밀착연접(tight junctions)을 피함으로써 서로 연결된다. 단지 매우 작은 친유성 분자(lipophilic molecule) 만이 수동확산(passive diffusion)에 의해 이러한 세포 장벽을 극복할 수 있다. 또한, 이러한 세포들은 이러한 친유성 물질들의 대부분을 혈류 안으로 수송하는 매우 효과적인 유출 운반체(efflux carrier)를 가지고 있다. 종합해 보면, 이러한 메커니즘은 대부분의 물질에 대해 완전히 기능하는(fully functioning) 장벽을 보장한다.
![혈관뇌장벽의 개요(von Kuebi = Armin Kübelbeck, and for the brain: Patrick J. Lynch [CC-BY-3.0 (http://creativecommons.org/licenses/by/3.0)], via Wikimedia Commons)](/assets/user/images/sub/info_new/img_08.jpg)
혈관뇌장벽의 개요(von Kuebi = Armin Kübelbeck, and for the brain: Patrick J. Lynch
CC-BY-3.0 (http://creativecommons.org/licenses/by/3.0)], via Wikimedia Commons)
나노입자 또는 리포솜(liposome)과 같은 미립자가 이러한 세포 장벽을 극복할 수 있으면 이러한 미림자는 특별히 적응된(specifically adapted) 표면 변형을 갖추어야 한다. 이러한 원리는 두 개의 무기성 나노입자(예컨대 금, 철)와 유기성 나노입자(예컨대 지질(lipid)-, 펩타이드(peptide) 또는 단백질 기반)에 적용된다.
뇌에 필수영양소 공급을 보장하고 잔체(residual body)와의 상호작용을 가능하게 하기 위해서 내피세포는 외부에 특정 수용체(receptor)를 가지며, 이러한 수용체는 ‘자물쇠 및 열쇠 원리(lock-and-key principle)’를 이용하여 결합 파트너(binding partner)를 뇌 안으로 능동적으로 수송한다. 아미노산, 포도당과 같은 영양소 및 주요 메신저(important messenger) 또는 신진대사 물질(단백질, 호르몬)이 결합 파트너로서 간주된다.
이러한 운반체 시스템은 또한 나노입자를 뇌에 수송하는데 사용될 수도 있다. 이를 위해서 열쇠와 같이 이러한 수송체(transporter)의 자물쇠 안으로 고정되는 각각의 리간드(ligand)는 직접적으로(공유 결합(covalent bound)에 의해) 또는 간접적으로(흡착 과정에 의해) 입자 표면에 연결되어야만 한다. 이와 같이 변형된 나노입자는 이제 ‘트로이목마’로서 작용한다. 이러한 변형은 단지 선택적인 화학적 또는 물리화학적 과정을 통해서만 달성될 수 있는데, 그 이유는 실제로는 그러한 연결 절차가 실행되지 않기 때문이다. 이러한 이유로 일반적으로는 나노입자가 혈관뇌장벽을 통과하지 않는다.
이러한 방법은 의학적으로 적용될 때 다수의 약물 및 다른 생물학적 활성 물질을 독소루비신(doxorubicin) – 뇌종양에 대한 항암화학요법(chemotherapy)에 사용됨 -과 같은 나노입자 또는 신경퇴행성질환(neurodegenerative diseases) 치료를 위한 다른 약물에 결합될 수 있는 기회들을 제공한다. 암 치료의 경우에 이러한 약물들은 정맥 안으로 투여된 후에 혈관 및 혈관뇌장벽을 통해 뇌 안으로 수송되며, 뇌 안에서 최종 목적지인 종양에 도달하게 된다. 이러한 코팅 및 부가된 결합 파트너가 없으면 동일한 나노입자도 효과가 없을 수도 있다. 현재 사용된 리간드는 다양한 단맥질 및 특정 항체를 포함한다.
나노입자 운반체 물질의 우수한 생체적합성(biocompatibility) 및 신속한 생분해성(biodegradation)이 의학적으로 코팅된 나노입자를 사용하기 위한 전제조건이다. 그러므로 오늘날의 전망에 따르면 단지 특별히 조제된 유기성 운반체 물질만이 이러한 목적에 부합될 수 있다.
이러한 리간드도 마찬가지로 비유기성 물질에 결합되기 때문에, 수송, 즉 이러한 메커니즘을 통한 금 나노입자의 뇌로의 수송이 가능할 수도 있다. 그러나 이러한 입자는 신속한 생분해가 이루어지지 않으므로 언급된 요건들을 충족시킬 수 없으며 인체에 사용되기에는 부적합하다. 진단 목적으로 사용된 철 나노입자는 또한 특정 코팅과 함께 고형지질 나노입자(SLN, solid lipid nanoparticles) 안으로 결합된 후에 혈관뇌장벽을 통해 수송될 수도 있다. 그러나 지금까지 인체 내에 적용될 경우 요구되는 독성학적 연구 및 제거(elimination) 연구는 생략되어 있다. 탄소나노튜브는 바늘 형태로 되어 있고 생분해성이 부족하여 뇌에 적용될 경우 약물 운반체로 적합하지 않다.
나노물질의 결정구조
온도나 압력과 같은 외부 조건에 의해 원자는 상이한 형태의 격자구조로 배열될 수 있다. 따라서 동일한 비율로 포함된 성분을 가진 몇몇 물질들은 상이한 결정구조(crystal structure)를 갖는다. 상이한 결정구조를 가진 나노물질들은 상이한 주요 물리화학적 특성(예컨대 반응성 또는 광촉매활성)을 지닌다. 따라서 그러한 경우에 단지 하나의 특정 결정구조가 적용에 따라 사용된다. 상이한 결정구조는 상이한 기술적 적용에만 관련되는 것이 아니라, 나노물질의 거동 및 독성에도 영향을 미칠 수 있다.
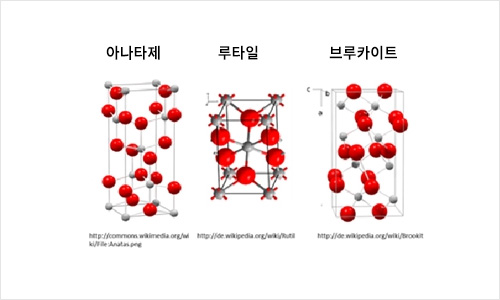
이산화티타늄의 상이한 결정구조
그러한 물질에 대한 한 예가 이산화티타늄(TiO2)이다. 이산화티타늄은 자외선 차단제 또는 페인트 내 백색안료로서 주로 루타일 형태로 첨가되는 반면, 광촉매에 적용될 경우에는(예컨대 자가세척 표면) 주로 아나타제(anatase) 형태가 사용된다.
이산화티타늄 뿐만 아니라 다수의 다른 나노물질들, 예컨대 산화철, 이산화규소 또는 탄소 등도 상이한 결정구조로 제공된다. 다이아몬드 또는 흑연(다중 그라핀 층) 형태 내에 격자가 발생할 수 있다. 다이아몬드는 그 견고성 때문에 예컨대 콘크리트를 자를 때 사용되는 반면, 흑연은 결정 격자의 우수한 변형성 때문에 윤활제로 사용된다. 따라서 상이한 결정구조의 변화하는 물질 특성으로 인해 광범위한 적용 스펙트럼이 제공된다.
나노물질의 다양한 결정구조는 유기체 또는 환경 거동에 미치는 부작용을 분석할 때 고려되어야 한다. 물질의 물리화학적 특성은 결정구조에 따라 상이한 것으로 알려져 있다.
이산화티타늄에서 입증된 바와 같이 아나타제 및 루타일 변태(modifications)는 유기체 및 세포에 대해 상이한 독성 효과를 나타낸다. 아나타제는 세포 및 유기체에 대해 독성 효과를 나타내는 반면, 루타일은 비독성으로 확인되었다. 이에 대한 이유로서 한편으로는 활성산소(ROS) 형성에 기여하는 아나타제 이산화티타늄의 광촉매 효과가 논의되고 있다. 다른 한편으로는 루타일 형태가 물에 잘 용해되지 않는 것으로 알려져 있다. 따라서 루타일 이산화티타늄은 집합체를 이루며 수성 시험 매체(aqueous test media) 안에 침전될 수 있는 것으로 알려지며, 따라서 유기체 및 세포는 단기간 동안에만 입자에 노출된다. 또한, 독성 효과에 대한 결정구조의 그러한 영향이 다른 나노물질에 대해서도 나타났다.
또한, 상이한 결정구조는 용해성(solubility) 또는 다른 물질들의 수착(sorption)과 같은 다른 나노물질 특성에 영향을 미칠 수 있다.
종합해보면, 결정구조는 물질 거동에 영향을 줄 수 있는 나노물질의 주요 특성으로서 잠재적 독성 효과를 변형시킬 수 있다.
나노물질에 접촉하게 되는 경로
나모물질의 표면 코팅에 대해 언급할 때 종종 변형(modification), 기능화(functionalization) 또는 안정화(stabilization)와 같은 용어가 사용된다. 이러한 용어의 다양성은 코팅을 사용하거나 의도된 기능에 대한 상이한 동기(motivation)를 반영한다.
일반적으로 나노물질의 표면 코팅은 다른 입자 특성을 선택적으로 변화시키거나 그 특성에 영향을 주기 위해 제공된다. 이를 위해서 입자의 표면(“코어(core))”은 결국 단일층 또는 다중 층(“셀(shell)”)을 발생시키는 매우 다양한 물질로 커버될 수 있으며, 이러한 층들은 완전하거나 불완전할 수 있다. 가능한 “셀” 물질에 대한 예를 아래의 표에서 볼 수 있다. 결과적으로 코팅된 나노물질의 최종 특성을 결정하는 것은 입자의 코어보다는 오히려 입자의 셀이 된다.
더 큰 입자와 비교해 볼 때 나노 크기의 물체(nano-scaled objects)는 특히 그 크기가 10nm 보다 작을 경우에는 노화된 표면 특성을 갖는다. 이는 아래 도면에 예시로 도시된 시스템의 전체 표면적에 대한 체적비(volume ratio)에 비해 큰 표면 때문에 기인한다. 이러한 새로운 특성은 생산, 프로세싱 및 최종 적용 단계에서 나타나는 입자의 거동 및 환경과 인간과의 상호작용에 있어서 결정적인 역할을 한다.
한편으로는 입자의 표면이 나노물질의 물리화학적 거동(예컨대 반응성 및 용해성) 또는 조직과의 양립성과 같은 생물학적 특성(의학에 적용될 때)에 영향을 미친다. 다른 한편으로는 그 표면은 또한 입자(들)와 다른 분자(예컨대 단백질) 그리고 상이한 종류의 표면들 간의 상호작용 레벨을 결정한다. 소정의 입자 코팅에 있어서 모든 종류의 분자들(단일 분자 또는 분자 그룹), 중합체 그리고 비유기층 또는 금속층이 사용될 수 있다. 전세계적으로 이용 가능한 매우 다양한 표면 코팅으로 인해 나노 물체(nanoobjects)의 특성은 개별 적용에 따라 조정될 수 있다.
나노물질의 결정구조
온도나 압력과 같은 외부 조건에 의해 원자는 상이한 형태의 격자구조로 배열될 수 있다. 따라서 동일한 비율로 포함된 성분을 가진 몇몇 물질들은 상이한 결정구조(crystal structure)를 갖는다. 상이한 결정구조를 가진 나노물질들은 상이한 주요 물리화학적 특성(예컨대 반응성 또는 광촉매활성)을 지닌다. 따라서 그러한 경우에 단지 하나의 특정 결정구조가 적용에 따라 사용된다. 상이한 결정구조는 상이한 기술적 적용에만 관련되는 것이 아니라, 나노물질의 거동 및 독성에도 영향을 미칠 수 있다.
아래의 표는 코팅의 유형, 기능성 및 이점에 대한 개요를 제시한다.
| 코팅의 역할 | 코팅 물질 | 비고 |
|---|---|---|
| (코팅되지 않음) | —- | |
| 용액 내 증가된 입자 안전성 | 분자, 중합체(10 – 100kDa), 하전된(charged) 중합체(전해질, 계면활성제) | 단일층, 대개 생산 및 프로세싱 단계에서 사용됨. |
| 습윤성(wettability)의 개선 | 분자, 증합체, 비유기층 | 물(친수성) 또는 유기용제 그리고 중합체(소수성 표면)와 나노입자로 이루어진 혼합물의 조제를 용이하게 하기 위함. |
| 예컨대, 은(Ag) 또는 산화아연(ZnO)에 있어서, 입자 코어 용해(dissolution)의 방지 | 비유기층, 대개 이산화규소(SiO2) | 작은 입자는 증가된 용해성을 가짐. 코팅층은 화학적 특성을 유지하고 용해를 막는데 유용함. |
| 물리적 그리고 화학적 기능의 개선, 증가된 효율성. | 비유기층, 대개 이산화규소 또는 이산화규소와 결합한 ZnO | 퀀텀닷(QDs, quantum dots)의 형광성은 특히 포화성(saturating) 자유표면(free surface)이 결합할 때 증가할 수 있음. |
| 비용 및 재료 절감 | 귀금속, 예컨대 팔라듐 | 비용 효율적인 기판 재료(코어) 상에 귀금속 촉매의 불완전한 박막층이 부가됨 |
| 보호 기능 | 유기층 | 예컨대 촉매독(catalyst poisons)으로부터 입자 기능의 보호 |
| 생체적합성 및 기능성 | 생체에 적합한 중합체 및 비유기층, 항체 및 펩타이드 | 생체에 적합한 SiO2 또는 폴리에틸렌글리콜(PEG)은 단백질 흡수, 진단 및 약물 수송을 축소시킬 수 있음. |
새로운 표면 특성은 또한 입자의 환경적 운명(environmental fate)에 부작용을 미치거나 영향을 미칠 수도 있다. 몇 가지 유형의 코팅 부작용에 대해서는 이미 보고된 바가 있다. 따라서 나노물질을 위한 코팅이 조사될 경우에는 코팅 또한 연구되고 평가되어야 한다.
- 제조 및 프로세싱 과정에 있는 코팅
- 생산 및 프로세싱 동안 또는 최종 제품에 있어서 대부분의 나노 물체는 (수성) 매체 내에 분산된 현탁액의 형태로 사용된다. 그러한 현탁액을 안정화시키고 침강(sedimentation) 또는 응집(agglomeration)을 방지하기 위해서 분자 또는 중합체가 입자 표면에 결합된다.
- 금(Au) 나노입자의 경우에는 시트르산(citric acid)이 종종 사용되며, 이산화티타늄(TiO2) 입자에는 중합체가 적합하다. 나노 물체의 또 다른 주요 특성은 물 또는 유기용제(organic solvents)에 의한 습윤성이다. 이러한 특징(습윤성)은 조절될 수 있고 특정 코팅에 의해 미세하게 조정될 수 있다. 소위 작용기(functional group)의 첨가가 용제와의 상호작용을 제어하기 위해 고려되고 필요에 맞게 적응될 수 있다.
- 나노 효과의 개선을 위한 코팅
- 두 번째로 중요한 코팅 그룹은 나노 효과를 개선하거나 강화하기 위해 구상되었다. 특히 그 코어가 셀렌화카드뮴(CdSe, cadmium selenide) 분자로 구성된 퀀텀닷(QDs)은 하나의 코팅을 필요로 한다. 첫째, CdSe – QDs는 불안정하고 이후에 용해된다. 둘째, QDs의 표면손상 때문에 전체 형광성이 감소된다. 그러므로 퀀텀닷을 위해 고안된 코팅은 특정 화학적 및 물리적 요건에 맞아야만 한다. 이러한 코팅은 입자 형광성에 영향을 미치지 않기 위해 투명해야 하고 소정의 장기간 안전성(long-term stability)을 제공할 수 있어야 한다.
- 의학에 적용될 경우 나노 물체의 코팅
- 나노 물체의 가장 복잡한 코팅은 의학적 용도로, 특히 진단 및 치료 목적으로 개발되었다. 산화철 이외에도 금 및 퀀텀닷이 코어 또는 운반체 나노물질로서 사용될 수 있다. 또한, 이산화규소(SiO2) 또는 탄소나노튜브(CNTs)에 기반한 코팅된 나노물질을 적용시키는 연구가 현재 수행되고 있다.
소정의 또는 선택된 코팅은 아래의 기준들을 충족시켜야만 한다
- 첫째, 생체적합성을 보장함
- 둘째, 혈액 내 제어된 체류시간(residence time)을 가짐, 및
- 셋째, 특정 세포 또는 기관으로의 적합한 수송.
입자 표면에 부가된 적합한 항체를 이용함으로써 코팅된 입자들은 기관 및 종양 세포 또는 염증이 생긴 부위와 같은 세포를 겨냥해서 방향이 설정되어야 한다. 기존에 존재하는 생체에 적합한 코팅은 또한 항체 결합을 위해 사용된다.
혈액 내 오랜 체류시간은 폴리에틸렌글리콜(PEG)의 표면 코팅에 의해 달성될 수 있다. 이와 반대로 짧은 체류시간 그리고 그에 따른 간 내 신속한 흡수는 덱스트란(dextran)을 이용하여 구현될 수 있다. 그러한 정교한 코팅을 가진 입자들은 최종 지름이 50nm 내지 100nm에 달하며, 코팅된 입자는 비유기성 코어(중심)보다 5배 내지 10배 이상 더 클 수 있다. 이러한 작용 과정에 의해 세포에 대한 입자의 거동은 대개 코팅의 구성(composition)에 의해 그리고 드물게는 최초 재료 입자(코어)에 의해 결정된다.


